Mi izobár hő 1
A belső energia testek
Szerint MKT valamennyi anyag részecskékből állnak, amelyek termikus folytonos mozgás és kölcsönhatásban vannak egymással. Ezért, még akkor is, ha a test helyhez kötött és a nulla potenciális energia azt energiával (belső energia), amely a teljes energia a mozgás és kölcsönhatását a mikrorészecskék alkotó test. A szerkezet a belső energia magában foglalja:
- a kinetikus energia a transzlációs, rotációs és vibrációs mozgást molekulák;
- potenciális kölcsönhatás energiája az atomok és molekulák;
- belüli-atom és a nukleáris energia.
A termodinamika tartja a folyamatok olyan hőmérsékleteken, amelyeken nincs rezgőmozgás van gerjesztett atomok a molekulák, azaz hőmérséklet nem haladja meg az 1000 K. csak az első két összetevő változás belső energiájának ezeket a folyamatokat. ezért
amelyet a belső energia termodinamika megérteni összege a kinetikus energia a molekulák és atomok, a test és a potenciális energia a kölcsönhatás.
A belső energia a test határozza meg a termikus állapotát, és cserélik le az átmenet az egyik állapotból a másikba. Ebben az állapotban a test egy jól meghatározott belső energia nem függ attól, hogy, mint a folyamat eredményeként kiderült ebbe az állapotba. Ezért a belső energiát gyakran nevezik függvényében kondíció.
Számolja belső energia csak az ideális gáz, mivel molekulák nem lépnek kölcsönhatásba egymással, és a bennük rejlő lehetőségeket az energia egyenlő a nullával:
U = \ dfrac \ cdot \ dfrac \ cdot R \ cdot T, \)
ahol i - a fokú szabadságot. Egy egyatomos gáz (például, inert gáz) i = 3 a kétértékű - i = 5.
Az is látszik az ezek a képletek, hogy a belső energia egy ideális gáz csak attól függ, a hőmérséklet és a molekulák száma, és független a volumen vagy nyomás. Ezért, a változás a belső energiája egy ideális gáz határozza meg változás csak annak hőmérséklete, és független a természet a folyamat, amelyben a gáz áramlik az egyik állapotból a másikba:
\ Delta U = U_2 - U_1 = \ dfrac \ cdot \ dfrac \ cdot R \ cdot \ Delta T, \)
- igazi gázmolekulák kölcsönhatásban vannak egymással, és ezért a potenciális energia Wp. ami függ a távolság a molekulák, és így a térfogatot a gáz által elfoglalt. Így a belső energiája a valódi gázok függ a hőmérséklettől, mennyisége és szerkezete a molekulák.
* A származtatása
Az átlagos kinetikus energiája a molekula \ (
\ Left \ Langle alagútrendszert W_k \ right \ rangle = \ dfrac \ cdot k \ cdot T \).
A molekulák száma gáz \ (
N = \ dfrac \ cdot N_A \).
Következésképpen a belső energia az ideális gáz
U = N \ cdot \ left \ Langle alagútrendszert W_k \ right \ rangle = \ dfrac \ cdot N_A \ cdot \ dfrac \ cdot k \ cdot T. \)
Tekintettel arra, hogy k⋅NA = R - az univerzális gázállandó, van
U = \ dfrac \ cdot \ dfrac \ cdot R \ cdot T \) - a belső energiája egy ideális gáz.
A változás a belső energia
Annak érdekében, hogy megoldja a gyakorlati kérdésekben fontos szerepet játszik nem a belső energia és a változás Au = U2 - U1. A változás a belső energia kiszámítása az energiamegmaradás törvényének.
A belső energia a test lehet kétféle módon változott:
- Ha mechanikai munkálatok elvégzésére. a) Ha a külső erő deformálja a test, ahol a változó közötti távolság a részecskék azt alkotó, és így változik a lehetséges kölcsönhatás energiája részecskék. Amikor rugalmatlan alakváltozások, sőt, a test hőmérséklete változik, azaz, változó a kinetikus energia a termikus a részecskék mozgását. De a munkát a deformáció a szervezetben, ami azt méri, hogy a változás a belső energia a szervezetben. b) Belső test energiát is változik annak rugalmatlan ütközés egy másik testet. Mint láttuk, a kinetikus energia rugalmatlan ütközés szervek csökken, úgy alakul át a belső (például, ha bejön egy párszor egy kalapáccsal egy wire feküdt az üllő - a huzal felmelegszik). Az intézkedés a változás a kinetikus energia a test szerint a tétel a mozgási energia, a munka a színészi erők. Ez a munka szolgálhat olyan intézkedés, a változás belső energia. c) a belső energia a test változás történik hatása alatt a súrlódási erő, mivel ismert, a tapasztalat, a súrlódás mindig kíséri a hőmérséklet változása a súrlódó testek. súrlódási erő munkája szolgálhat olyan intézkedés, a változás belső energia.
- A rendszer segítségével a hőt. Például, ha a test kerül a láng az égő, a hőmérséklet-változás, ezért változtatni, és a belső energia. Azonban nem a munka nem kerül sor, mert nincs látható mozgása vagy a test vagy annak részei.
A változás a belső energia a rendszer munka nélkül nevezett hőcserélő (hőátadás).
Háromféle hőátadás: hővezetés, konvekció és sugárzás.
a) hővezetés nevezik közötti hőátadás folyamatában a testek (vagy testrészek) saját közvetlen érintkezés által okozott véletlenszerű hőmozgás részecskék a szervezetben. A rezgés amplitúdója egy merev test a molekulák nagyobb, annál magasabb a hőmérséklet. A hővezető gázok miatt az energia közötti gázmolekulák ütközések. Mindkét mechanizmus működik a folyadékok esetében. A hővezető szilárd anyagok maximális és minimális a gáz halmazállapotú.
b) konvekciós hőátadási fűtött folyadék vagy gáz áramlik az egyik térfogata részletben általuk elfoglalt másokban.
c) a sugárzási hőátadás végezzük távolságban segítségével elektromágneses hullámok.
Tekintsük részletesebben módon a változás belső energia.
mechanikai munka
Ha figyelembe vesszük a termodinamikai folyamatokat mechanikai mozgás a makroszkopikus testek nem tekinthető egészére. A munka fogalmát társul térfogatváltozás a test, azaz a macrobody mozgó alkatrészek egymáshoz képest. Ez a folyamat vezet a változás a részecskék közötti távolság, és a gyakran változtatni a sebességét a mozgás, így, a változás a belső energia a test.
izobár
Nézzük először izobár. Tegyük fel, hogy egy henger egy mozgatható dugattyút egy gáz a T1 hőmérsékleten (ábra. 1).
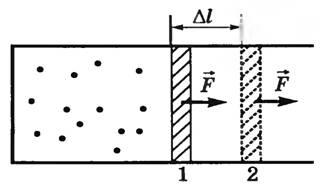
Lassan melegítse a gázt olyan hőmérsékletre T2. Izobár gáz bővül, és a dugattyú mozog a 1-es pozíciótói 2 által távolságban DL. Az erő a gáznyomás így nem működik a külső szervekkel. Mivel p = const, majd a nyomást F erő = p⋅S is állandó. Ezért a munka ezen erő lehet kiszámítani a következő képlettel
A = F \ cdot \ Delta l = p \ cdot S \ cdot \ Delta l = p \ cdot \ Delta V, \)
ahol aAV - váltás a gáz térfogata.
- Ha a gáz térfogata nem változik (izochor folyamat), a művelet gáz nulla.
- Gáz munka csak a folyamat változó térfogatú.
Upon expanziós (aAV> 0) készült pozitív munkagáz (A> 0); Nyomó (aAV <0) газа совершается отрицательная работа (А <0).
- Ha figyelembe vesszük a művelet a külső erők A „(A” = -A), majd az expanziós (aAV> 0) a gáz A ' <0); при сжатии (ΔV <0) А '> 0.
Az egyenlet Mengyelejev-Clapeyron gáz két állapot:
p \ cdot V_1 = \ nu \ cdot R \ cdot T_1, \; \; p \ cdot V_2 = \ nu \ cdot R \ cdot T_2, \)
p \ cdot (V_2 - V_1) = \ nu \ cdot R \ cdot (T_2 - T_1) \).
Következésképpen, amikor a izobár
A = \ nu \ cdot R \ cdot \ Delta T. \)
Ha ν = 1 mol, amikor ΔΤ = 1 Ahhoz, hogy R jelentése számszerűen egyenlő A.
Ezért a fizikai értelemben az egyetemes gázállandó. Ez számszerűen egyenlő a által végzett munka egy mól ideális gáz alatt izobár melegítve 1 K.
Nem izobár
A grafikon p (V) alatti izobár folyamat munka egyenlő a vonalkázott terület a 2. ábrán, és a téglalap.
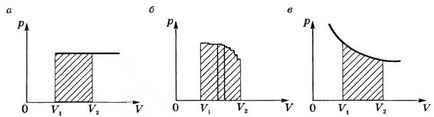
Ha a folyamat izobár (2B.), A görbe a függvény p = f (V) lehet leírni, mint egy szaggatott vonal, amely egy nagy számú isochors és isobar. Munka az izochor szakaszok nulla, és a teljes munka minden területén egyenlő lesz izobár
A = \ lim_ \ sum ^ N_ p_i \ cdot \ Delta v_i \), vagy a \ (
A = \ int p (V) \ cdot dV, \)
azaz Ez egyenlő lesz a terület az árnyékolt figura.
Amikor izoterm folyamat (T = const) munka egyenlő a terület vonalkázott alakja a 2. ábrán látható, a.
Határozzuk meg működését a fenti képlet alkalmazásával, csak akkor használható, ha ismert, mint a gáz nyomása változik a térfogata, azaz ismert formája a függvény p = f (V).
Így látható, hogy még ugyanaz a munka gáz térfogata függ az átmeneti folyamat (azaz, a folyamat: izoterm, izobár, ...) a kezdeti állapotban a végső gáz. Ezért arra lehet következtetni, hogy a
- Munka termodinamika függvénye a folyamatot, és nem függvénye az állam.
A hő mennyisége
Mint ismeretes, amikor különféle mechanikus eljárások megváltoztatja a mechanikus energia W. Az intézkedés változtathatja meg a mechanikai energia dolgozik erőt kifejteni a rendszer:
Amikor a hőátadás megváltoztatja a belső energia a szervezetben. Az intézkedés a változás belső energia a hőcserélő hőmennyiség.
A hőmennyiség - intézkedés a változás belső energia a folyamat hőcserélő.
Így mind a munka és a hőenergia mennyisége jellemzi a változás, de nem azonos a belső energia. Ezek nem jellemzi az állam a rendszer maga (akárcsak a belső energia), és meghatározza az energia átmenet az egyik formából a másikba (egyik testből a másik), amikor az állam, és lényegében jellegétől függ a folyamat.
A fő különbség a munka és a hőmennyiség, amely
- munka leírja a folyamat változó a belső energia a rendszer kíséretében energiaátalakító egyik formából a másik (miatt a belső mechanikai);
- hőmennyiség jellemzi belső energia átvitelét egyik testből a másik (egy több fűtött egy kevésbé fűtött) nem kíséri az energia átalakulások.
Fűtés (hűtés)
A tapasztalat azt mutatja, hogy a hőmennyiség melegítéséhez szükséges a testtömeg m hőmérséklet T1 T2 hőmérsékleten. Úgy kell kiszámítani, az általános képletű
Q = c \ cdot m \ cdot (T_2 - T_1) = c \ cdot m \ cdot \ Delta T, \)
ahol c - a fajhője az anyag (táblázatos érték);
Az egység a fajhő SI a Joule kilogrammonként-Kelvin (J / (kg · K)).
Specifikus teploemkostc számszerűen egyenlő a hőmennyiség, amelyet meg kell adni, hogy a testtömeg 1 kg, melegítsük 1 K.
Figyelembe véve a fajhő értéke, mint a test hőkapacitása.
A fajhő C test számszerűen egyenlő a hőmennyiség szükséges változások a testhőmérséklet 1 K:
Az egység a test hőt SI a joule per Kelvin (J / K).
Elpárologtatás (kondenzáció)
Az átalakítás a folyadékpárolgási állandó hőmérsékleten hőmennyiség szükséges, hogy fordítsuk
ahol L - a specifikus párolgási hőt (táblázatos érték). Párakicsapódást szabadul azonos mennyiségű hőt.
Az egység specifikus párolgási hőt SI joule per kilogramm (J / kg).
Olvadás (kristályosító)
Annak érdekében, hogy megolvasszuk a kristályos m tömegű olvadási hőmérséklet a test, a test kell jelenteni a hőmennyiség
Q = \ lambda \ cdot m, \)
ahol λ - fúziós hője (táblázatos érték). az azonos mennyiségű hő szabadul fel a kristályosodás testet.
Az egység a fajhője olvadás SI joule per kilogramm (J / kg).
tüzelőanyagok elégetése
A hőmennyiség szabadul teljes elégetése során a tüzelőanyag m tömegű.
ahol q - specifikus égéshő (táblázatos érték).
Az egység egyedi égéshő a SR joule per kilogramm (J / kg).