Termodinamikai folyamatok ideális gázok
Jellemzői a főbb termodinamikai folyamatokat ideális gázok változásaival, mint a hőmérséklet, térfogat, nyomás, és a gáz termelt munkát.
Típusú folyamatokat. A fő folyamatok mérnöki termodinamika, nagyon fontos, mind elméleti és alkalmazott módszerek, a következők:
Helmholtz - folyó állandó térfogaton;
izobár - folyó állandó nyomáson;
izoterm - áramló állandó hőmérsékleten;
adiabatikus - ahol nincs hőcsere a környezetre;
politrop - kielégíti a következő egyenletet PV n = const.
Az első négy folyamatok különleges esetekben az politrop folyamatot.
A tanulmány e folyamatok határozzák meg a folyamat egyenlet koordináták p, v és T, s közötti kommunikáció a gáz halmazállapotban paraméterek mérése a belső energia, a nagysága a külső munka és a hő mennyisége szórakozott.
Izochor folyamat. Amikor izochor állapotváltozás állapotban dv = 0 vagy v = const. ideális gáz egyenlet
azaz Gáznyomás egyenesen arányos az abszolút hőmérséklet:
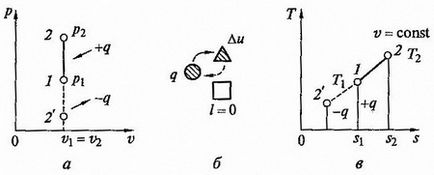
Ábra. 2.4 izochor állapotváltozás, hogy p - V és T - s diagramok (A, C) és az energia-egyensúlyt áramkör (b)
Process Charts p - v és T - s - diagramok, valamint energetikai egyensúly ábrán bemutatott áramkör. Munka expanziós ebben a folyamatban nulla, mivel a dv = 0. A hőmennyiség jut a munkaközeg során 1 - 2 állt CV = const. arányából határozzuk meg az
Mivel az L = 0. Ekkor összhangban az első főtétele
Izobár. Úgynevezett izobár folyamat lezajlását állandó nyomáson. Az ideális gáz állapotegyenlet ha p = const talál
azaz A izobár gáztérfogat arányos az abszolút hőmérséklet (Gay-Lussac-törvény). Process Charts p - v és T - s - diagramok, és ttakzhe znergoballansa ábrán látható diagram. 2.5.
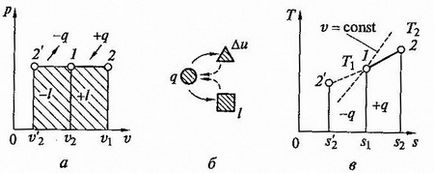
Ábra 2.5. Izobár, hogy p - V és T - s - diagramok (A, C) és az energia-egyensúlyt áramkör (b)
A juttatott hő mennyisége, hogy a gáz melegítés hatására (vagy hűtés közben, hogy nekik) található a következő egyenletből
Az izoterm folyamat. Állandó hőmérsékleten izoterm folyamat, ezért, pv = RT = const vagy p2 / p1 = v1 / v2. azaz nyomás és térfogat fordítottan arányos egymással, úgy, hogy egy izotermikus kompresszió a gáz nyomása növekszik, és a tágulás során - esik (Boyle - Mariotte).
A grafikon az izoterm folyamat koordináták p, v (Fig.2.6, a) egy egyenlő szárú hiperbola, melyek a koordináta tengelyek asimptomami.
Mivel az energia nem változik, akkor a belső energia egy ideális gáz a folyamat állandó marad (Au = 0) és az összes külső hőt a gázt teljesen átalakul munka expanziós q = l.
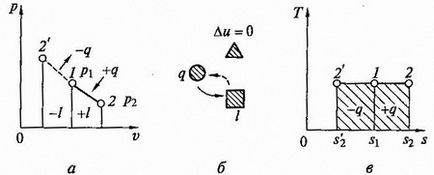
Ábra. 2.6. Izoterm folyamat p - V és T - s - diagramok (A, C) és az energia-egyensúlyt áramkör (b)
Az izotermikus kompresszió A gáz hőtartalmának eltávolítjuk megfelelő összeg a költségek a kompressziós munkát. A rendszer és ütemezése az energiamérleg és izobár folyamat T -s - ábrán látható diagram. 2.6, b, c.
Adiabatikus folyamat. Nevezett folyamat adiabatikus változások gáz halmazállapotú, amely akkor következik be anélkül, hogy a hőcsere a környezetet. Ez a folyamat megfelel az esetben, amikor a tartályt vagy a lámpaburával gáz, hőszigetelt a környezettől. Erre az esetre egyenlet első főtétele, hiszen usloviyudq = 0 formáját ölti
Ez azt jelenti, hogy a folyamat adiabatikus munkát csak a kiadások belső energiája a gáz, és a tömörítés, hogy zajlik a keresetet a külső erők, a munkát a számukra, hogy növeljék a belső energia a gáz.
Jelöljük a fajhő egy adiabatikus folyamat a kertben, és kifejezett feltétellel du = 0 a következő:
Ez azt mutatja, hogy az adott hőt az adiabatikus folyamat egyenlő nulla, azaz Garden = 0. Ismert, hogy a
Egyenletben adiabatikus görbe folyamat (adiabatikus) a koordináták p, v (Fig.2.7 a) a formája
ahol k - az úgynevezett adiabatikus index (ezt az értéket is nevezik Poisson-tényező).
azaz technikai munkát adiabatikus folyamat egyenlő entalpiakülönbség a kezdete és vége a folyamatnak.
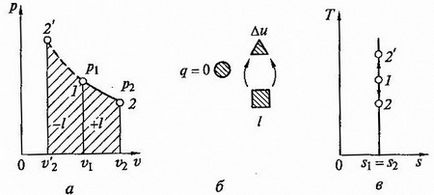
Fig.2.7 Adiabptny folyamatot p - V és T - s liagrammah (A, C) és az energia-egyensúlyt áramkör (b)
Adiabatikus folyamat előforduló nélküli belső súrlódást a munkaközeg, az úgynevezett izentropikus. A T -s diagram (2.7 ábra, c) ez képviseli egy függőleges vonal.
Általában az igazi adiabatikus folyamatok zajlanak jelenlétében belső súrlódás a munkaközeg, miáltal a hő mindig megjelent, amely haladéktalanul jelenteni kell a munkaközeg. Ebben az esetben a DS> 0, akkor a folyamatot nevezzük a tényleges adiabatikus folyamat.
Politrop folyamatot és általánosító értéket. Úgynevezett politrop folyamat, amely állandó hőkapacitása és írja le a következő egyenlet
Politrop n kitevő vehet minden számértéket a tartományban -∞ és + ∞, de állandó adott folyamat számára.
Egyenlet (2.13) és az egyenlet a Clapeyron könnyű megszerezni kifejezések kapcsolatos a pv és T bármely két pont a politrop:
Politrop eljárás általánosítása az értéket, amely az összessége alapvető termodinamikai folyamatokat.