Az első főtétele
Első start (első törvénye) főtétele - ez a törvény megőrzése és átalakítása energia termodinamikai rendszer.
Az első főtétele, a munka csak akkor végezhető el a hőt, vagy valamilyen más formában energiát. Következésképpen, a művelet és a hőmennyiség mértük ugyanabban az egységben - joule (és energia).
A termodinamika első főtétele által is megfogalmazott német tudós Yu L. Mayer 1842-kísérletesen igazolták az angol tudós, John. Joel 1843
A termodinamika első főtétele az alábbiak szerint történik:
A változás a belső energia a rendszer alatt átmenet az egyik állapotból a másikba az összegével egyenlő a külső erők, és a hő mennyisége. Az átviteli rendszer:
ahol Au - változás a belső energia, A - a külső erők munka, Q - átadott hőmennyiség, hogy a rendszer.
Tól (Au = A + Q) a következőképpen megmaradási törvénye a belső energia. Ha a rendszer el van szigetelve a külső hatásokkal, akkor a = 0 és Q = 0. és így Au = 0.
Ha bármely folyamatok zajlanak egy elszigetelt rendszer, a belső energia állandó marad.
Ha a rendszer működik, nem pedig külső erő, akkor az egyenlet (Au = A + Q) van írva, mint:
,
ahol A '- által végzett munka a rendszer (A' = -A).
Az átadott hőmennyiség, hogy a rendszer, van egy változás a belső energia, és hogy a rendszer működik, a külső szervekkel.
A termodinamika első főtétele kiszerelhető lehetetlensége örökmozgó az első fajta, amely tevékenységet végzett anélkül hogy energiát bármilyen forrásból (pl. E. Csak rovására a belső energia).
Valóban, ha a szervezet nem betáplált hő (Q 0), akkor a művelet A”. a következő egyenlet szerint, ezt úgy végezzük, csak a rovására a belső energia veszteség A „= -δU. Miután a tápegység fog kimerülni, a motor leáll.
Emlékeztetni kell arra, hogy a munkát. és az a hőmennyiség, amelyek jellemzői a változás belső energia a folyamat, így nem lehet azt mondani, hogy a rendszer tartalmaz egy bizonyos mennyiségű hő vagy munka. A rendszer csak egy bizonyos belső energia bármilyen állapotban.
Az I. főtétel különböző folyamatokat.
Tekintsük a kérelmet a termodinamika első főtétele különböző termodinamikai folyamatokat.
Izochor folyamat.
A funkció p (T) egy termodinamikai diagramon ábrázolt isochore.
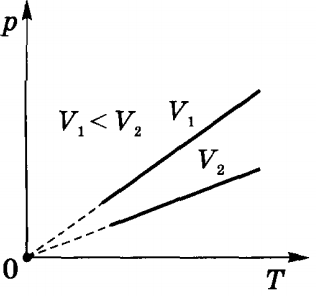
Izochor (izochor) folyamat - termodinamikai folyamat előforduló a rendszerben állandó térfogaton.
Izochor állapotváltozás lehet elvégezni gázok és folyadékok zárt edényben állandó térfogatú.
Amikor izochor állapotváltozás gáztérfogat nem változik (Av = 0), és a szerint az első főtétele,
t. e. változás a belső energia egyenlő hőmennyiség átruházott, t. k. munkájában (A = rδV = 0) a gáz nem kerül végrehajtásra.
Ha a gáz melegítjük, akkor Q> 0, és Au> 0. belső energiája nő. Hűtés közben a gáz Q <0 и δU <0. внутренняя энергия уменьшается.
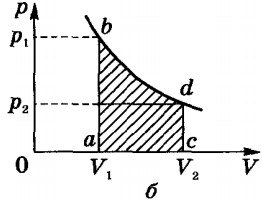
Az izoterm folyamat.
Izotermikus folyamatot grafikusan izoterma.
Izoterm folyamat - a termodinamikai folyamat előforduló a rendszerben állandó hőmérsékleten.
. Mint egy izoterm folyamat a belső energiája a gáz nem változik, lásd képletű (T = const), akkor az összes továbbított gáz mennyisége hő megy a pontozási művelet:
Fogadásakor a hőt gáz (Q> 0), akkor végez munkát (A „> 0). Ha a gáz adja le a hőt a környezetbe Q <0 и A' <0. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой p(V) .
Izobár.
Gibbs termodinamikai folyamatábra ábrázolt isobar.
Gibbs (izobár) folyamat - termodinamikai folyamat előforduló rendszerben állandó nyomás p.
Példák a izobár folyamat bővítése a gáz a hengerbe, hogy járni szabadon rugóerő tárolós dugattyú.
Amikor a izobár folyamat, képlet szerint, a hő mennyisége továbbítani kell a gáz, hogy változtassa meg a belső energia és Au elkövetése művelet A „állandó nyomáson:
Alkalmazási ideális gáz határozzuk meg egy telek p (V) izobár (A „= pδV).
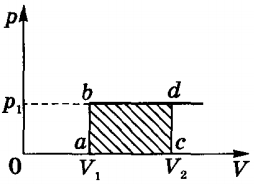
Egy ideális gáz alatt izobár mennyiség arányos a hőmérséklet. valós gázok hőfogyasztásának változást átlagos kölcsönhatás energiája részecskéket.
Adiabatikus folyamat.
Adiabatikus folyamat (adiabatikus folyamat) - ez a termodinamikai folyamat előforduló a rendszert anélkül, hogy a hőcsere a környezettel (Q = 0).
Adiabatikus szigetelési rendszer az érték kb Dewar edények, úgynevezett adiabatikus membránok. Az adiabatikus izolált rendszer nem befolyásolja a hőmérséklet változásának környező szervek. A belső energia U lehet változtatni csak a munkát a külső szervek által a rendszerben, vagy maga a rendszer.
Az első szerint főtétel (Au = A + Q), az adiabatikus rendszert
ahol A - a munka a külső erők.
Amikor adiabatikus a gáz A <0. Следовательно,
,
azt jelenti, hogy a hőmérséklet csökkenése alatt adiabatikus. Ez vezet az a tény, hogy a gáz nyomása csökken nagyobb mértékben, mint az izotermikus folyamat. Ábra alábbi 1-2 adiabatikus között húzódó két izoterma grafikusan szemlélteti ezt. Terület adiabatikus számszerűen egyenlő a munkát végez a gáz alatt adiabatikus a mennyiséget V1. V2.
Adiabatikus kompresszió növekedéséhez vezet a gáz hőmérséklete, hogy az, hogy eredményeként a rugalmas ütközések gázmolekulák a dugattyú az átlagos kinetikus energia növekszik, ellentétben a kiterjesztés, amikor csökken (az első esetben a sebesség a gázmolekulák növekszik, a második - redukált) ...
A hirtelen fűtés a levegőt az adiabatikus kompressziós használt Diesel motorok.
Hő egyensúly egyenlet.
A zárt (izoláltuk a külső szervek) termodinamikai rendszer változása a belső energia a test δU1 rendszer nem eredményez változást a belső energia az egész rendszer. ezért
Ha a rendszeren belül nem tesz a munka nem testek, akkor szerint az első főtétele, a változás belső energia a test kerül sor, csak a hőcsere a más szervek a rendszer: δUi = Qi. Figyelembe véve, kapjuk:
,
Ez az egyenlet az úgynevezett hő egyensúly egyenlet. Van Qi - több hőt. kapott vagy törli -edik szervezetben. Bármely mennyiségű hő is jelentheti, Qi keletkező hő vagy abszorbeált olvadása során egy test, égés, elpárolgás és a kondenzáció a gőz, ilyen eljárások fordulhat elő, ha különböző szerveket a rendszer, és meghatározza a megfelelő arányokban.
Hő egyensúly egyenlet egy matematikai kifejezés a törvény az energiamegmaradás során hőcsere.