A kinetikája enzimes reakciókat 1
Enzimkinetikát vizsgálja a hatását a kémiai jellege a reagáló anyagok (enzimek, szubsztrátok) és azok kölcsönhatása feltételek (koncentráció, pH, hőmérséklet, aktivátorok jelenlétében vagy inhibitorok) a sebességét az enzimatikus reakció. A enzimreakció sebességének (V) által mért csökkenése vagy növekedése a szubsztrát mennyisége a termék egységnyi idő.
Amikor a enzimes katalízis, az enzim (E) reverzibilisen kapcsolódik a hordozó (S), amely egy átmeneti enzim-szubsztrát komplex (ES), amely a végén a reakció, bomlik a kibocsátást az enzim (E) és a reakció termékek (F):
Fontos jellemzője a enzimes reakciók - a telítettség az enzim szubsztrát. Alacsony koncentrációjú szubsztrát a reakció sebessége egyenesen arányos a koncentrációjával. Amikor a magas - maximális reakciósebesség állandó lesz, és független a szubsztrátum koncentrációja [S], és teljesen határozza meg az enzim koncentrációját (11. ábra).
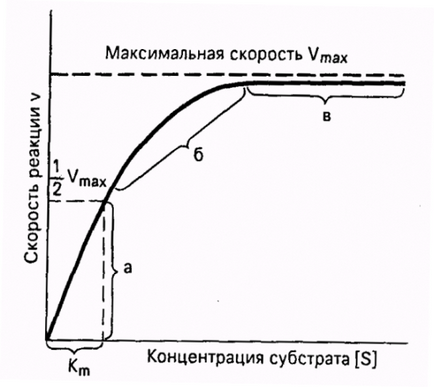
Ábra. 11. függése enzimatikus reakció sebességét a szubsztrát koncentrációjával konstans enzim koncentrációt.
KS - disszociációs állandója az enzim-szubsztrát komplex ES, fordított egyensúlyi állandó:
Minél kisebb az érték KS. Minél magasabb az affinitása az enzim a szubsztrátumot.
A kvantitatív összefüggés van a a szubsztrát koncentrációja, és enzimreakció sebességét fejezi Michaelis-Menten egyenlet szerint:
,
u - a reakció sebességét, Vmax - maximális sebesség egy enzimatikus reakció.
Briggs és Haldane javult az egyenlet beírással Michaelis-állandó KM. kísérleti úton határozzuk meg.
Egyenlet Briggs - Haldane:
A Michaelis-állandó számszerűen egyenlő a szubsztrátum koncentrációja (mól / l), ahol az arány a enzimatikus reakció fele a maximális (12.). Km mutatja affinitása az enzim a szubsztrátumot; A kisebb érték, annál nagyobb az affinitás.
Kísérleti értékek Km legtöbb enzimatikus reakciókat az egyik szubsztrát rendszerint 10 -2 -10 -5 M. Ha a reakció reverzibilis, a kölcsönhatás az enzim egy szubsztrát jellemezhető közvetlen reakció Km. eltér a fordított reakció szubsztrátja.
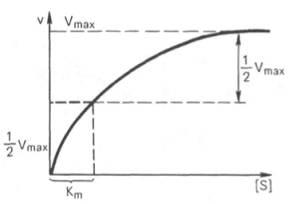
Ábra. 12. Grafikus opredeleniekonstanty Michaelis.
Enzimek különböznek a hagyományos katalizátorok, számos tulajdonságait.
Hőre érzékenynek. vagy érzékenység a hőmérséklet emelkedés (13.).
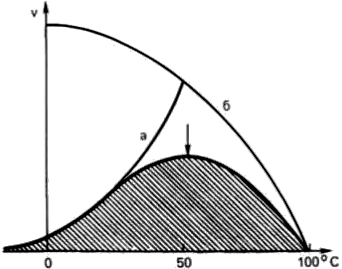
Ábra. 13. és a hőmérséklet összefüggése az enzimatikus reakció sebességét.
A hőmérséklet nem haladja meg a 45-50 ° C-on, a legtöbb biokémiai reakciók aránya növekszik 2-szer, ha a hőmérséklet emelkedik 10 ° C-on (tipikusan van't Hoff). Feletti hőmérsékleten 50 ° C-on a reakció sebessége kezdi kifejteni nagy befolyást hődenaturációs enzimfehérje vezető teljes megszűnése fermentációs eljárás.
A hőmérséklet, amelynél a katalitikus aktivitását az enzim maximális, az úgynevezett a hőmérséklete optimális. Hőmérséklet optimális a legtöbb emlős enzimek belül 37-40 ° C-on Alacsony hőmérsékleten (0 ° C-on, és az alábbiakban) enzimek általában nem esnek össze, bár aktivitásuk esik közel nullára.
A függőség a az enzim aktivitása a közeg pH-ja (14.).
van egy optimális pH-érték, amelynél ez mutat maximális aktivitást minden egyes enzim esetében. pH-optimum az enzimatikus aktivitás fekszik egy szűk sávban hidrogénion-koncentráció, alkalmas állati szövetekben dolgozott ki az evolúció során fiziológiás pH-értékeken 6,0-8,0. Kivételek a pepszin - 1,5-2,5; argináz - 9,5-10.
Szerint jelen nézetek, a hatása változik a pH a az enzim-molekula van téve a harmadlagos szerkezetét a fehérje.
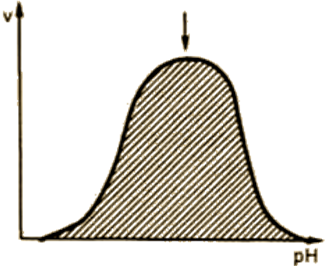
Ábra. 14. függése enzimatikus reakció sebességének pH.
Sajátosságai. A nagy specifikus hatással miatt enzimek konformációs és az elektrosztatikus komplementaritás molekulái között a szubsztrátum és az enzim és egyedi szerkezeti szerveződését az aktív hely, amely egy a reakció szelektivitására.
Abszolút specificitás - sposobnostfermenta katalizálják egy reakció. Például, ureáz katalizálja a hidrolízis reakciója karbamid NH3 és CO2.
Relatív (csoport) specifitás - a képességét, hogy az enzim katalizálja reakciók csoportja egy adott típusú. Relatív specifitást, azaz például, hidrolitikus enzimek rendelkeznek peptidázok hidrolizálnak peptid kötések a fehérjék molekulákat és peptideket.
Sztereokémiái specificitása van enzimek, amelyek katalizálják csak az egyik regioizomerek. Fumarázenzim enzim katalizálja az malát be csak a transz-izomer-fumarát, és nincs hatása a cisz-izomer a maleinsav.
A nagy specifitást az enzim hatására egy áramlását bizonyos kémiai reakciók minden lehetséges transzformációt.