Enzimkinetikát - studopediya
Enzimkatalízis jelentősen eltér a nem-enzimatikus, így a kinetikai enzimatikus reakciók kifejlesztett nagyon különleges mintákat. Ezek lehetővé teszik, hogy megkülönböztessék enzimkinetika egy külön részén kémiai kinetika, amely tanulmányozta a függőség mértékének reakciók által katalizált enzimek, a koncentráció a reagáló anyagok (enzimek és szubsztrátok) és feltételei a kölcsönhatás (hőmérséklet, pH, koncentráció
Koenzimek és kofaktorok, a jelenléte a különböző effektor: aktivátorok és inhibitorok).
A tanulmány a kinetikája enzimatikus hatása igen nagy elméleti jelentősége, mert csak abból a szempontból kinetika lehet megközelíteni, hogy a kérdést a mechanizmus enzimes lépéseket. De az is szükséges, a gyakorlati helyzetben, mint csak úgy, bizonyos információkat kinetikáját fellépés különleges enzim, akkor lehet választani az optimális körülményeket annak működését, valamint arra, hogy befolyásolja a tevékenységét egy adott irányba különböző szakaszaiban a folyamatot.
Kapcsolatos kérdések kinetikája enzimes reakciók részletes bemutatására vonatkozó szakaszaiban biokémia és Enzymology, ezért összpontosít azokat a pozíciókat, amelyek szükségesek a illetékes megközelítés dolgozni enzimek: a szelekciós körülmények meghatározására enzim aktivitását, meghatározzuk a kezdeti sebességét az enzimatikus reakció, a választás a szubsztrát, megállapítása telített koncentrációja, optimális fellépés hőmérséklet és pH, befolyása kofaktorok, aktivátorok és inhibitorok.
A enzim jelenlétében oldat vagy kivonat alapján lehet meghatározni a sebességet a reakció által katalizált őket, ami lehet becsülni sem a felhalmozódása reakciótermékeket vagy elvesztése szubsztrát.
A legtöbb enzimatikus reakció vegyes sorrendben reakciók. Egy tipikus görbe során az enzimatikus reakció (. 8.1 ábra) a következő:
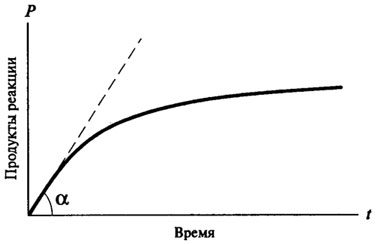
Ábra. 8.1. A görbe a haladás az enzimatikus reakció ideje
Így, az idő folyamán az enzimatikus reakció nem leírható egy matematikai egyenlet, mivel az összes enzimes reakciók legelején előfordulásuk (ha van feleslegben szubsztrát és képződött kis reakciótermékeket) vannak
nulla rendű reakciók, és csak azt követően szerezhet a karakter a reakció első vagy másodrendű. Nulla rendű reakció ideje nem változik, a függőség a képződött termék mennyiségét időről időre egyenesen arányos a (lásd. Ábra. 8.2). A reakciói elsőrendű reakció bármely adott időben arányos a rendelkezésre álló szubsztrát koncentrációja, és ennek következtében, van egy állandó csepp a reakció sebessége az idő függvényében (lásd. Ábra. 8.3).
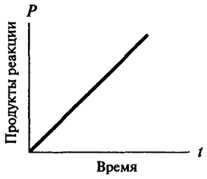
Ábra. 8.2. Grafikus ábrázolása egy nulladrendű reakciót
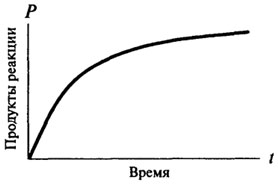
Ábra. 8.3. Grafikus ábrázolása egy elsőrendű reakció
Annak érdekében, hogy helyesen meghatározni a potenciális ezt enzim katalizátor, szükséges figyelembe venni a sebességet az enzimatikus reakció egy időpontban, amikor a tényezők lassítja a sebességét az enzimatikus reakció (hiánya szubsztrát, a specifikus gátlása a reakciótermékek, részleges hődenaturácíót az enzim, stb), nem kell idő, hogy megmutassák a hatás, és van-e közvetlen arányos összefüggés a reakciótermékek és az időt.
Ez a sebesség az úgynevezett kezdeti sebességét az enzimatikus reakció, és jelöljük V0.
A gyakorlatban V0 határozzuk meg grafikus módszerrel, amely építeni görbe során az enzimatikus reakció időt. Kezdeti sebesség kerül meghatározásra a lejtőn a húzott érintő a származási a görbe során az enzimatikus reakció (lásd. Ábra. 8.1).
Amikor dolgozik egy adott enzimmel, a reakcióidő kell kiválasztani alapján kísérleti adatok a kezdeti reakció sebességét.
Attól függően, hogy a feladat, hogy szembesíti a kutatók, vagy a szakemberek, akik dolgoznak enzimekkel, válassza az egyik vagy a másik megközelítés ebben a munkában. Ez arra utal, hogy a következő.
1. Ha szükséges izolálni és jellemezni az enzimet bármely biológiai tárgy, élelmiszer alapanyag, hogy alkalmazni bármilyen ismert elválasztási és tisztítási rendszert, illetve, hogy dolgozzon optimális rendszer az enzim változtatásával és különböző kombinációinak tesztelése alapvető lépéseket tisztítására és izolálására enzim (fehérje): extrakció, kicsapás a különböző módok, gél kromatográfiával vagy más módszerekkel különbségek alapján fiziko-kémiai jellemzői a specifikus enzimek (lásd. még fejezet. 2.). Minden egyes szakaszában elválasztására és tisztítására enzimkészítmény kell jellemezni az enzimaktivitás és a fehérjetartalom. Ebben az esetben, a meghatározását enzimatikus aktivitás (meghatározás F0) hajtjuk végre standard szubsztrátot; azonosítani az optimális pH és hőmérséklet. Még további tanulmányok telítési szubsztrát koncentrációja, pH és hőmérsékleti optimum. Hatásának vizsgálata specifikus aktivátorok és inhibitorok lehetővé teszi ebben az esetben, hogy értékes információkat a szerkezet az aktív hely, és a lehetséges mechanizmusa a katalitikus hatás. Szükséges hangsúlyozni alapos módszertani megközelítés, ha dolgozik, enzimeket. kell követnie időt és erőfeszítést, hogy válasszon az extrakciós módban (időtartam, hőmérséklet, extrakciós szer, a típusú extrakciós - teljes vagy nem), a választott módszerek aktivitásának meghatározására, a finomítás és a lehetséges módosítást jelent az adott tárgya tanulmány; Ezen kívül dolgozik különböző tisztasági enzimek is megvan a saját jellemzői, a maga sajátossága: van egy különböző pH és termikus stabilitása, és ezenkívül, lehet eltérően reagálnak a hatását a különböző tényezők.
2. Ha a feladat az, hogy meghatározzuk, hogyan fog viselkedni aktív enzim (enzimkészítmény) egy adott üzemmódban tekinthető élelmiszer-technológia, szükséges, hogy végezzen enzimatikus hatását körülményei között ezt a folyamatot (szubsztrát koncentráció, időtartamát, a pH, hőmérséklet, páratartalom), hogy vizsgálja meg a hatását a különböző élelmiszer-összetevők és a felhasznált nyersanyagok adalékok a enzimaktivitás meghatározása céljából a lehetőséget, és a módját, hogy befolyásolja a fermentációs eljárás egy kívánt útmutató NII.
Mi most úgy a befolyásoló tényezők mértéke enzimatikus reakciókat.
Hatás a szubsztrát koncentrációnak az arány enzimatikus reakció. A szubsztrát koncentrációja egy fontos tényezője a sebességét az enzimatikus reakció. 1902-ben. W. Henry a tanulmány az enzimatikus hidrolízis szacharóz azt javasolta, hogy az enzim p-fruktofuranozidáz kölcsönhatásba lép a szubsztráttal, majd ezt a
vegyület elbomlik, az enzim továbbra is az eredeti formájában, és a szubsztrát a szacharóz hasítódik a glükóz és fruktóz.
Ez a javaslat fejlesztette tovább L. Michaelis és M. Menten. 1913-ban, ezek feltételezték a következő egyenlet enzimatikus reakció:
ahol k + 1 - a reakció sebességi állandója komplexképződés ES, K-1, k + 2 - reakció sebességi állandóit a bomlási a komplex ES két irányban.
Ezután Ks - disszociációs állandója ES komplex az arány a visszirányú és előre állandó reakció sebesség:
A forrás a sok félreértés a múltban és a jelenben, a helytelen használata a „Michaelis konstans” és a két Ks Km karaktereket is nem azonos az értéke egyáltalán, annak ellenére, hogy nagyon világos ajánlás Az enzim Bizottság, a Nemzetközi Biokémiai Unió. Az első érték -KS - egyensúlyi állandó, arányával fejezzük ki Ks =
Ez jellemzi az affinitása az enzim a szubsztrátumot (vagy, alternatív módon, ES komplex erősítő), ahol van egy inverz arányossági bázisadat nagysága közötti Ks és affinitása az enzim a szubsztrátumot. A második érték a megfelelő-km szubsztrát koncentráció, amelyben V = Vmax / 2. Gyakran Ks tulajdonság tévesen tulajdonított km. Ha valóban Km lesz azon affinitás mértéke, az enzim a szubsztrátumot csak egy esetben, ha az érték a k + 2 van olyan kicsi, hogy szinte egybeesik Km Ks.
Sok enzimek katalizálják a reakciót két szubsztrátum. Az úgynevezett bimolekuláris reakciók közé tartoznak a kémiai reakciók átadási csoportok egyik vegyületet egy másik, a szintézis reakció, redox reakció.
Ezek a reakciók léphetnek fel két különböző mechanizmussal. A reakciókat az első típusú, az úgynevezett egyetlen helyettesítési reakciók, két szubsztrát A és B forma egy enzim komplex EAB, amely aztán bomlik alkotnak reakciótermékek a C és D A második típusú dvuhsubstratnyh reakció mechanizmus szerint a kettős helyettesítés (mechanizmusa „ping-pong”) . Ezekben a reakciókban az aktív központ az enzim minden egyes időpillanatban társított csak az egyik két szubsztrát.
Abban a vizsgálatban, a kinetikája bimolekuláris reakciók, a koncentráció az egyik szubsztrátum a bal állandó (B), és a második - változó (A). Ebben az esetben, 1 / V koordináták 1 / [A] állíthatjuk elő "látszólagos" érték K t. A valódi érték Vmax és K B, m kapjuk a tanulmány a különböző koncentrációjú szubsztrát W. Hasonlóképpen, amikor meghatározzuk a kapott K A m (amikor a koncentráció A jelentése állandó, és változik a koncentráció). Rm tekintetében a különböző szubsztrátok ugyanabban a reakcióban, eltérő lehet - ez világosan látható a következő példa.
A katalizált reakció az alkohol-dehidrogenáz:
etanol acetaldehid
A Km-értéke: alkohol dehidrogenáz-élesztő: